Você está na sessão de Leucemia Linfoide Aguda, para ver sobre outras Leucemias CLIQUE AQUI
Última atualização em 24 de maio de 2023
LEUCEMIA LINFÓIDE AGUDA TEM CURA?
Um paciente Leucemia Linfóide Aguda tem duas opções de tratamento: padrão ou clínico experimental. É importante conversar com a equipe médica sobre a melhor opção de tratamento.
Um diagnóstico de LLA está associado a uma ampla gama de resultados. Portanto, é essencial procurar tratamento em um centro especializado. Os pacientes de LLA precisam de tratamento assim que recebem o diagnóstico. Se o quadro do paciente permitir, ele ainda pode buscar uma segunda opinião, para se sentir mais confiante.
Converse com seu médico sobre:
- Suas opções de tratamento e os resultados que você pode esperar
- Os resultados esperados com a terapia padrão
- Sobre a participação em um estudo clínico
Considerações quanto ao pré-tratamento. Adultos em idade fértil e pais de crianças com diagnóstico de LLA devem pedir ao médico informações sobre como lidar com o risco de infertilidade.
QUAIS OS TRATAMENTOS DISPONÍVEIS?
LEUCEMIA LINFOIDE AGUDA PROGNOSTICO
“Fatores prognósticos” são fatores que podem afetar a perspectiva ou o prognóstico do paciente e ajudam a prever uma expectativa de como a LLA de um paciente vai reagir ao tratamento. Esses fatores ajudam os médicos a planejar o tratamento inicial mais adequado, bem como os ajuda a determinar se o transplante de células-tronco é uma opção de tratamento e quando deve ser realizado.
Fatores prognósticos para crianças com LLA incluem:
- Idade: as células de leucemia em crianças com menos de 1 ano e crianças com mais de 10 anos tendem a ser mais resistentes ao tratamento, por isso tratamentos mais fortes podem ser necessários para eliminar estas células.
- Contagem de glóbulos brancos: as crianças com contagens de glóbulos brancos maior ou igual a 50.000/mm3 no momento do diagnóstico também necessitam de um tratamento mais intenso.
- Certas mudanças nos cromossomos (alterações citogenéticas) ou genes podem tornar as células de leucemia mais fáceis ou difíceis de serem tratadas.
- A presença de células de leucemia no líquido cefalorraquidiano e/ou nos testículos no momento do diagnóstico.
- Como o paciente responde à terapia de indução inicial. Pacientes que têm uma melhor resposta à terapia de indução, geralmente têm um menor risco de recaída da doença.
Crianças com LLA de alto risco de recidiva geralmente recebem tratamento mais intenso que crianças com LLA de risco padrão.
Fatores prognósticos para adultos com LLA incluem
- Idade: as células de leucemia em pacientes mais velhos tendem a ser mais resistentes ao tratamento. Pacientes com mais de 35 anos apresentam redução na duração da remissão, e maior dificuldade em tolerar aquimioterapia.
- Contagem de glóbulos brancos: os pacientes com contagens de glóbulos brancos superiores a 30.000/mm3 para a linhagem B e superiores a 100.000/ mm3 para a linhagem T no momento do diagnóstico geralmente tem duração da remissão reduzida.
- Certas mudanças nos cromossomos ou genes podem tornar as células da leucemia mais fáceis ou mais difíceis de serem tratadas.
- Se as células de leucemia são encontradas no líquido cefalorraquidiano no momento do diagnóstico.
- Como o paciente responde à terapia de indução inicial. Pacientes que respondem melhor à terapia de indução geralmente apresentam menor risco de recidiva.
COMO É O TRATAMENTO DE QUIMIOTERAPIA PARA LEUCEMIA LINFÓIDE AGUDA?

Quimioterapia
A quimioterapia é o tratamento de longo prazo mais utilizado para a LLA.
Geralmente dura cerca de 2 a 3 anos e é intensa, especialmente nos primeiros meses. A maioria dos tratamentos utilizam um coquetel de medicamentos.
Os medicamentos quimioterápicos eliminam as células de crescimento rápido em todo o corpo, tanto as células cancerosas, como as células normais e saudáveis, e funcionam de maneiras diferentes. Por isso é comum utilizar mais de um tipo de medicamento quimioterápico.
A quimioterapia é frequentemente administrada em ciclos. Cada ciclo é composto por um número de dias de tratamento seguidos por alguns dias de descanso, para que o corpo possa descansar e se recuperar. Os ciclos variam de duração, dependendo de quais quimioterápicos são usados.
Alguns medicamentos quimioterápicos são aplicados via intravenosa (na veia), e pode levar alguns minutos, horas ou vários dias (infusão contínua). A quimioterapia intravenosa é administrada por meio de um cateter, que será colocado cirurgicamente sob a pele na parte superior do tórax do paciente.
Veja como é o tratamento de quimioterapia para a Leucemia Linfóide Aguda
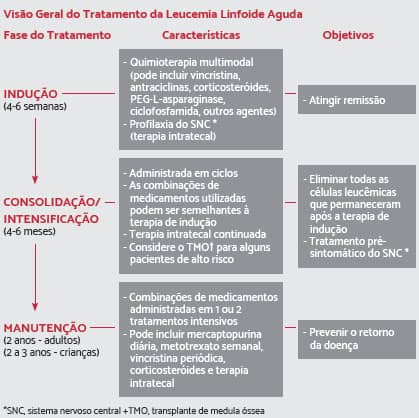
Existem três fases de tratamento que são mais comuns: indução, consolidação (ou intensificação) e manutenção. A consolidação e a manutenção são aplicadas após a remissão.
Terapia de Indução
É a fase inicial da quimioterapia. A medicação, as dosagens utilizadas e o momento da administração dependem de vários fatores, incluindo a idade, as características da leucemia e a saúde geral do paciente. O objetivo da terapia de indução é destruir o máximo de células da leucemia a fim de alcançar/induzir à remissão. Esta terapia geralmente utiliza vários medicamentos, que incluem: vincristina, antraciclinas (daunorrubicina, doxorrubicina) e corticosteroides (prednisona, dexametasona), administrados com ou sem asparaginase e/ou ciclofosfamida.
A gravidade da doença e os efeitos colaterais da terapia de indução podem levar a um período de internação de 4 a 6 semanas. Crianças e alguns pacientes que têm um cuidador e moram perto do centro médico são liberados para irem para casa mais cedo. Para algumas crianças, a permanência hospitalar é a primeira experiência delas fora de casa por um longo período de tempo. Informar sobre a doença e o tratamento de forma apropriada, ajudará a criança a confiar em você e na equipe de tratamento. Falar sobre seus medos e preocupações também ajudará seu filho a se sentir mais confortável.
Ao final da terapia de indução, os médicos irão avaliar se o paciente alcançou a remissão completa. Ela ocorre quando:
- Nenhuma célula de leucemia é detectada na medula óssea (com um microscópio)
- Tem menos de 5% de blastos na medula óssea
- Não tem blastos no sangue periférico
- As contagens de células do sangue voltam ao normal
- Todos os sinais e sintomas de LLA desapareceram
Mesmo quando uma remissão completa é alcançada, algumas células de leucemia que não podem ser vistas com um microscópio ainda podem permanecer no corpo. A presença dessas células é chamada de “doença residual mínima (DRM)”. Pacientes que chegaram à remissão após o tratamento inicial para LLA, mas têm DRM, têm maior risco de recidiva da doença.
Depois que um paciente atinge a remissão completa, a terapia pós-remissão é administrada para destruir todas as células de leucemia remanescentes no corpo.
O medicamento Blinatumomabe (Blincyto®) é aprovado para tratar adultos e crianças com LLA de células precursoras B em remissão, mas ainda com DRM maior ou igual a 0,1%. Geralmente, se os blastos ainda são evidentes após o primeiro ciclo de quimioterapia de indução, um segundo ciclo de quimioterapia, usando diferentes quimioterápicos, é indicado.
Profilaxia e Tratamento do Sistema Nervoso Central (SNC)
Embora a presença de blastos no líquido cefalorraquidiano ao diagnóstico não seja comum (3 a 7% dos casos), sem o tratamento profilático (preventivo) mais de 50% dos pacientes desenvolverão leucemia do SNC. Assim, a profilaxia é administrada a todos os pacientes durante todas as fases do tratamento para evitar que as células leucêmicas se espalhem para o cérebro e a medula espinhal.
A terapia dirigida ao sistema nervoso central pode incluir:
Quimioterapia intratecal
Os medicamentos são injetados na parte inferior da coluna, com a agulha entre duas vértebras (ossos da coluna), em uma área cheia de líquido que fica entre as finas camadas de tecido que cobrem o cérebro e a medula espinhal. Esses medicamentos podem incluir metotrexato, citarabina e dexametasona.
Quimioterapia sistêmica em altas doses
Os medicamentos injetados no sangue atravessam uma membrana entre o vaso de sangue e o SNC (barreira hematoencefálica) e incluem metotrexato, citarabina, dexametasona 6-mercaptopurina e asparaginase.
Irradiação craniana
É a radioterapia do cérebro. Em pacientes pediátricos (exceto se com leucemia do SNC ou recidiva do SNC) não é usada. O tratamento sem radiação diminui as chances de o paciente apresentar efeitos tardios, como danos aos órgãos, desenvolvimento de segundo câncer e ainda comprometimento neurocognitivo.
Alguns medicamentos usados para tratamento e/ou estudos clínicos de LLA são:
Antibióticos antitumorais
- Daunorubicina
- Doxorubicina
- Mitoxantrona
- Idarubicina
Inibidor de enzima de reparo de DNA
- Etoposide
Agentes que danificam o DNA
- Cyclophosphamide
- Ifosfamide
Enzimas que impedem as células de sobreviver
- Asparaginase
- Pegaspargase
Inibidores da tirosina quinase
- Mesilato de imatinibe
- Dasatinibe
- Nilotinibe
- Bosutinibe
- Ponatinibe
Antimetabólitos
- Clofarabina
- Citarabina
- Fludarabina
- Hidroxiureia
- 6-mercaptopurina
- Metotrexato
- Nelarabine
- 6-thioguanine
Drogas que impedem as células de se dividir
- Vincristina
- Sulfato de vincristina lipossomal
Hormônios sintéticos (corticoides)
- Prednisona
- Metilprednisolona
- Dexametasona
Imunoterapia
- Alemtuzumabe
- Rituximabe
- Ofatumumabe
- Blinatumomabe
- Inotuzumabe ozogamicina
- Tisagenlecleucel
Esta lista inclui tanto os medicamentos já utilizados no tratamento e os que estão sendo testados em estudos clínicos para o tratamento da LLA.
Terapia de consolidação (consolidação, reindução e manutenção)
Inclui os tratamentos administrados aos pacientes após a sua doença estar em remissão completa. Como na fase de indução, fatores como a idade do paciente, a capacidade de tolerar o tratamento intensivo, a citogenética, a disponibilidade de um doador de células-tronco e outras considerações, podem influenciar a abordagem do tratamento.
Consolidação
A segunda fase da quimioterapia é chamada de terapia de consolidação ou de “intensificação”. Terapia de consolidação é aplicada somente quando a LLA já está em remissão. O objetivo é destruir todas as células de leucemia remanescentes no corpo após a terapia de indução. Durante esta fase, os medicamentos quimioterápicos são administrados em doses mais altas que as administradas durante a fase de indução. A terapia de consolidação geralmente dura de 4 a 6 meses.
A combinação de medicamentos e a duração da terapia para protocolos de consolidação variam, mas podem consistir de combinações de drogas similares àquelas usadas durante a fase de indução. Após a fase de consolidação, alguns protocolos de tratamento fazem uma reindução, que consiste num tratamento intensificado, usando drogas semelhantes às da terapia de indução. Vários quimioterápicos são combinados para ajudar a impedir que as células de leucemia desenvolvam resistência.
Algumas das drogas usadas na fase de tratamento de consolidação incluem:
- Metotrexato em altas doses
- Citarabina
- Vincristina
- 6-mercaptopurina
- Blinatumomabe
- Inotuzumabe ozogamicina
- Ciclofosfamida
- Asparaginase
- Corticosteroides (prednisona, dexametasona).
MANUTENÇÃO DO TRATAMENTO DE QUIMIOTERAPIA PARA LEUCEMIA LINFOIDE AGUDA
A terceira fase do tratamento da LLA é chamada de “manutenção”. O objetivo é prevenir a recidiva da doença após a terapia de indução e a consolidação. A maioria dos medicamentos de manutenção são de administração oral e os pacientes são tratados em ambiente ambulatorial. Eles recebem doses mais baixas de quimioterápicos e, como resultado, tendem a ter efeitos colaterais menos graves. A terapia de manutenção geralmente dura cerca de 2 anos para adultos e 1 ano e meio a 2 anos, para crianças. Em alguns casos, a quimioterapia pós-remissão também inclui medicamentos que não foram utilizados durante o tratamento de indução. A maioria dos tratamentos de manutenção inclui:
- 6-mercaptopurina diariamente
- Metotrexato semanalmente
- Vincristina
- Corticosteroides (prednisona, dexametasona)
- Quimioterapia intratecal
Quais são os efeitos colaterais causados pelos tratamentos de LLA?
A maioria dos efeitos colaterais são temporários e desaparecem quando o corpo se ajusta à terapia ou quando a terapia é completada. As drogas quimioterápicas atacam rapidamente a divisão das células, tanto as doentes, quanto as normais. As células da medula óssea, as células da mucosa da boca e intestino e os folículos do cabelo se dividem rapidamente e podem ser afetadas pela quimioterapia. Os efeitos da quimioterapia podem ser diferentes e depender dos medicamentos usados.
Baixa contagem de células sanguíneas
A quimioterapia pode ser tóxica tanto para as células sanguíneas normais como para as células da LLA, levando à diminuição importante no número de glóbulos vermelhos, glóbulos brancos e plaquetas. As transfusões de sangue (glóbulos vermelhos e plaquetas) são quase sempre necessárias durante o tratamento. A contagem de células do sangue geralmente retorna aos níveis normais após o tratamento.
Muitos efeitos colaterais da quimioterapia são causados devido às baixas contagens de glóbulos brancos. Medicamentos conhecidos como “fatores de crescimento” podem ser usados para estimular a medula óssea a produzir novos glóbulos brancos, reduzindo a chance de infecções graves. Os mais utilizados são os fatores estimuladores de colônias de granulócitos (G-CSF) e o fator estimulante de colônias de granulócitos-macrófagos (GM-CSF).
Infecção
A deficiência de glóbulos brancos pode levar a infecções por bactérias e fungos que estão normalmente presentes no ambiente, na pele, no nariz e na boca, nas gengivas ou no intestino. O risco de infecção é elevado porque, além dos glóbulos brancos baixos, a quimioterapia danifica as células que revestem a boca e o intestino, facilitando a entrada de bactérias na corrente sanguínea. Quando a contagem de glóbulos brancos é baixa, antibióticos para prevenir infecções bacterianas e medicações que previnem infecções fúngicas e virais são ministrados.
Pelo fato do paciente de LLA ser mais vulnerável a infecções, a equipe médica, a família e os amigos precisam aumentar o rigor dos hábitos de higiene e tomar precauções para evitar a exposição desse paciente a bactérias, vírus e outros agentes causadores de infecção. Os cateteres também precisam de atenção especial quanto à limpeza frequente.
Os pacientes devem procurar atendimento médico imediato diante do menor sinal de infecção. Uma temperatura de 38oC ou mais, ou o início de calafrios, pode ser o único sinal de infecção em um paciente com uma contagem muito baixa de leucócitos.
Outros sinais incluem tosse persistente, dor de garganta, dor para urinar ou diarreia. Os pacientes que têm LLA são aconselhados a tomar algumas vacinas. É recomendado que as crianças recebam uma vacina anual contra influenza (gripe).
Já os pacientes adultos são aconselhados a tomar vacina pneumocócica e a contra a influenza. As vacinas com organismos vivos, como a varicela (catapora) a poliomielite oral (Sabin) ou a tríplice viral (sarampo, caxumba, rubéola) não devem ser administradas. Se um membro da família ou um amigo receber uma vacina com organismos vivos, o paciente deve manter-se distante dele por um período de tempo (varicela 6 semanas, Sabin 3 semanas).
Síndrome de Lise tumoral
Os pacientes com LLA apresentam alto risco para o desenvolvimento de uma condição chamada “síndrome de lise tumoral”, que ocorre no início da terapia de indução quando o número de glóbulos brancos é muito alto. À medida que as células da leucemia morrem, elas se rompem e liberam seu conteúdo na corrente sanguínea, alterando o equilíbrio normal de substâncias químicas no sangue. Isso pode sobrecarregar os rins porque eles não conseguem eliminar as substâncias de uma só vez.
O ácido úrico é uma das substâncias químicas liberadas pelas células da LLA que estão morrendo. Níveis muito elevados de ácido úrico e outros produtos químicos podem causar sérios danos aos rins e ao coração. Se a síndrome não for tratada, o paciente pode ter arritmias cardíacas, convulsões, perda de controle muscular, insuficiência renal aguda e até chegar a óbito. Por isso, no início do tratamento, os pacientes com LLA são constantemente monitorados quanto ao desenvolvimento dessa síndrome, e recebem medicamentos como alopurinol ou rasburicase para prevenir ou diminuir os efeitos da síndrome de lise tumoral.
Outros efeitos colaterais da quimioterapia
Os quimioterápicos destroem as células que se dividem rapidamente e, portanto, agem tanto nas células do câncer quanto nas células saudáveis que se dividem rapidamente (revestimento dos intestinos, pele e folículos pilosos). Entre os efeitos colaterais, os mais comuns são:
- Aftas
- Diarreia
- Perda de cabelo
- Erupções cutâneas
- Comichão na pele
- Náusea e vômito
- Dores de cabeça
- Perda de apetite
- Fadiga
- Neuropatia: dormência, formigamento ou fraqueza muscular (geralmente nas mãos ou pés).
Normalmente esses efeitos colaterais são de curto prazo e tendem a desaparecer quando o paciente termina o tratamento. Felizmente, medicamentos que neutralizam náuseas e vômitos podem ser ministrados.
Corticoides, como prednisona e dexametasona, são componentes principais de praticamente todos os protocolos de indução de LLA, além de serem frequentemente incorporados aos protocolos de consolidação e manutenção.
Os efeitos colaterais agudos podem incluir hiperglicemia (aumento do açúcar no sangue) e diabetes melitus e, portanto, os pacientes devem ser monitorados para controle da glicemia. Outro efeito colateral potencial é a úlcera gástrica. Medicamentos que reduzem o ácido do estômago são recomendados para reduzir o risco de úlcera gástrica.
As terapias específicas usam medicamentos ou outras substâncias que têm como alvo as células específicas do câncer, destruindo-as e sendo menos propensas a atacar as células normais. As terapias específicas bloqueiam a ação de enzimas, proteínas ou outras moléculas envolvidas no crescimento e divisão das células do câncer. Outras ajudam o sistema imune a destruir as células de câncer ou distribuem substâncias tóxicas diretamente para as células de câncer e as matam.
As terapias específicas podem causar menos efeitos colaterais que os outros tipos de tratamentos para o câncer. Elas são:
- Inibidores de tirosina quinase: Cerca de 25% dos adultos e 3% das crianças com LLA tem um subtipo da doença chamado “LLA Ph-positivo” (LLA cromossomo Philadelphia positivo). Na LLA Ph+ o cromossomo Philadelphia contém a fusão genética anormal BCR-ABL, que fabrica uma proteína anormal responsável por ajudar as células da leucemia crescerem. Os inibidores de tirosina quinase são usados para tratar a LLA Ph+, pois inibem a proteína BCR-ABL. Além deles, a LLA
Ph+ também é tratada com combinação de quimioterapia: Os seguintes inibidores de tirosina quinase estão disponíveis para tratar LLA Ph+:
- Imatinibe (Glivec®), via oral, é aprovado para adultos e em pediatria (acima de 1 ano) como primeira linha de tratamento junto com quimioterapia ou recidiva ou refratária
- Dasatinibe (Sprycel®), via oral, é aprovado para adultos com LLA Ph+ com resistência ou intolerância à terapia anterior
- Ponatinibe (Iclusig®), via oral, é aprovado para adultos com LLA Ph+ T315Ipositivo, ou que são resistentes ao dasatinibe, ou que são intolerantes ao dasatinibe e o tratamento com imatinib não é apropriado. Não está aprovado no Brasil
Efeitos colaterais comuns dos inibidores da tirosina quinase incluem diminuição das células do sangue, sangramento, náusea, vômito, diarreia, fadiga, erupções cutâneas, dores de cabeça / músculo / osso / e juntas. Também podem causar retenção de líquido debaixo dos olhos, mãos, pés ou pulmão.
Efeitos colaterais raros, mas sérios, são arritmia cardíaca, estreitamento dos vasos sanguíneos e formação de coágulo sanguíneo. O Dasatinibe pode causar retenção de líquido perto dos pulmões. Os efeitos do Ponatinibe incluem coágulo sanguíneo, estreitamento dos vasos sanguíneos, ataque cardíaco, derrame, problemas no fígado ou inflamação no pâncreas.
COMO SE DÁ O TRANSPLANTE DE MEDULA ÓSSEA NA LEUCEMIA LINFÓIDE AGUDA?
Alguns pacientes podem se beneficiar do transplante de células-tronco, que objetiva curar o paciente destruindo as células do câncer na medula óssea. Antes do procedimento, utiliza-se altas doses de quimioterapia e, em seguida, as células da medula óssea são substituídas por células-tronco novas e saudáveis, que crescem e se multiplicam.
Existem dois tipos principais de transplante de células-tronco:
ALOGÊNICO: os pacientes recebem células-tronco de um doador 100% compatível, que pode ser um parente ou não, ou ainda ser um parente 50% compatível (transplante haploidêntico).
AUTÓLOGO: os pacientes recebem suas próprias células-tronco. O transplante de células-tronco não é usado como o primeiro tratamento para LLA. Pode ser usado em pacientes de alto risco ou que não respondem ao tratamento. É um tratamento complexo e pode acarretar efeitos colaterais que podem ser fatais. A decisão de se submeter a um transplante deve ser discutida com o médico. Ele irá considerar vários fatores, incluindo a idade do paciente, a saúde geral, certos fatores prognósticos, tratamentos anteriores e se há um doador compatível.
TRANSPLANTE ALOGÊNICO
Transplante de medula óssea alogênico é o tipo de transplante de medula óssea mais comum para tratar a LLA. Na preparação, o paciente é submetido à quimioterapia, com ou sem radiação, com objetivo de matar as células doentes remanescentes e reduzir imunidade do paciente para aceitar a medula do doador. Então, o paciente recebe infusões de células-tronco advindas de um doador, que pode ser um membro da família, um desconhecido cadastrado no REDOME (Registro Nacional de Doadores de Medula Óssea) ou até mesmo de um cordão umbilical.
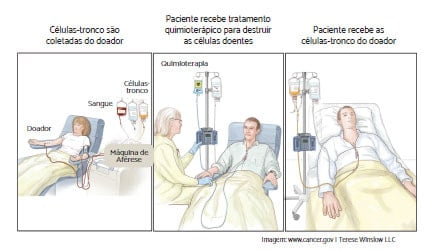
O TMO alogênico cria um novo sistema imune para o paciente, que ajudará o corpo a brigar contra infecções e contra as células cancerígenas que possam ter sobrado. As células imunes transplantadas (chamadas de enxerto) enxergam as células leucêmicas no corpo como estranhas e as destrói. Isto é chamado de “efeito enxerto versus leucemia”.
O transplante alogênico de células-tronco, comparado a outras abordagens de tratamento, está associado a uma taxa mais alta de efeitos colaterais e mortalidade. Pode, no entanto, ser considerado para pacientes com LLA de alto risco, com base em resultados de testes citogenéticos e moleculares. A decisão de realizar um transplante alogênico também depende da idade do paciente e de seu entendimento sobre os possíveis benefícios e riscos: O limite superior de idade para transplante varia de acordo com o centro de tratamento; muitos usam a idade de 60 ou 65 anos como limite para o transplante alogênico e 70 anos para o transplante alogênico de intensidade reduzida.
A maioria das crianças com LLA não requerem de um transplante, mas pode ser uma opção para as que apresentam fatores de alto risco ou nas quais a doença é persistente.
Estudos demonstram que o transplante alogênico pode beneficiar pacientes adultos de alto risco e risco intermediário com menos de 60 anos de idade e que têm como doador um irmão compatível. O tempo para o transplante é um dos fatores mais importantes que influenciam os resultados, por isso é fundamental iniciar uma busca de doadores o mais rápido possível após o diagnóstico, a fim de identificar um doador da família ou não aparentado.
Após o transplante das células-tronco, um possível efeito colateral grave é a doença do enxerto contra o hospedeiro (GVHD). Ela ocorre quando as células imunes do doador (o enxerto) identificam as células no corpo do receptor (o hospedeiro) como estranhas e as atacam. As partes do corpo mais comumente danificadas pela GVHD incluem a pele, o fígado, o estômago, os intestinos e os olhos. A doença do enxerto contra o hospedeiro pode se desenvolver dentro de semanas após o transplante ou muito mais tarde. Um médico pode pedir medicamentos que possam ajudar a prevenir ou minimizar GVHD.
Transplante Alogênico de intensidade reduzida.
Pode ser uma opção de tratamento para pacientes idosos que não podem tolerar as altas doses de quimioterapia usadas na preparação para um transplante alogênico padrão. A terapia de condicionamento em um transplante de intensidade reduzida utiliza doses menores de quimioterapia e / ou radiação para preparar o paciente para as células do doador.
A terapia reduz o número de células cancerosas, mas não destrói completamente a medula óssea do paciente. Como em um transplante alogênico padrão, os glóbulos brancos do doador também podem reconhecer quaisquer células de leucemia remanescentes como estranhas, e destruí-las. Com o passar do tempo, se o transplante for bem-sucedido, as células-tronco do doador substituirão as células imunológicas do paciente. As células enxertadas (imunes do doador) reconhecem os antígenos de tecido menores nas células de leucemia do paciente e continuam a suprimir seu crescimento. Como também ocorre no transplante alogênico, o risco de DECH é um efeito colateral a ser considerado e é potencialmente incapacitante.
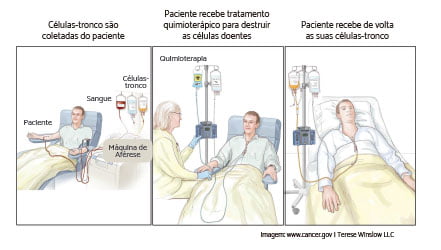
Transplante de Células-Tronco Autólogo
O transplante de medula óssea autólogo acontece quando a medula óssea do próprio paciente é removida, congelada e armazenada após conquistar a remissão. Uma vez que as células estão congeladas, o paciente recebe altas doses de quimioterapia adicionais e/ou radioterapia. Um transplante autólogo não é comumente utilizado para tratar a LLA, mas pode ser uma opção de tratamento para quem participa de estudos clínicos. Conversar com o médico sobre o transplante de células-tronco é o melhor caminho. Pergunte se é uma opção de tratamento para você ou seu filho.
O QUE É IMUNOTERAPIA?
A imunoterapia é uma terapia que utiliza substâncias que estimulam e/ou suprimem o sistema imune para ajudar o corpo a combater o câncer. Existem tratamentos de imunoterapia que tem como alvo antígenos na superfície dos blastos da LLA, os anticorpos monoclonais.
Anticorpos monoclonais.
São proteínas produzidas em laboratório que se ligam a antígenos (tipo de proteína) nas células do câncer. A maioria se liga a uma substância específica. Esses medicamentos podem ser usados sozinhos para destruir as células do câncer ou para carregar medicamentos, toxinas ou substâncias radioativas diretamente para as células cancerígenas. Na LLA eles atacam os antígenos da superfície dos blastos. Anticorpos monoclonais importantes na LLA seriam para destruir os antígenos CD19, CD20, CD22, D33 e CD52 dos blastos.
Como exemplo temos:
Blinatumomabe (Blincyto®).
É um anticorpo monoclonal contra o CD19 indicado em adultos e crianças com LLA B recidivada ou refratária ou adultos com LLA B com doença residual mínima positiva que já atingiram remissão completa. Sua administração é na veia, lentamente, em infusão contínua durante 28 dias. Necessita internação nos primeiros dias do tratamento.
Efeitos colaterais desse medicamento incluem:
- Febre
- Dor de cabeça
- Infecção
- Náusea
- Diarreia
- Suor
- Complicações neurológicas como convulsões, confusão, desorientação, fala arrastada e perda de equilíbrio
Inotuzumabe ozogamicina (Besponsa®).
É um anticorpo monoclonal contra o CD22 indicado como monoterapia para o tratamento de adultos com LLA B recidivada ou refratária. Está junto com um medicamento quimioterápico e quando se liga ao antígeno CD22 nas células B, ele entra na célula e libera o quimioterápico calicheamicina, causando a morte da célula. A administração é via intravenosa e pode ser feita ambulatorial. Efeitos colaterais comuns incluem aumento do risco de infecções, sangramento, fadiga, febre, náusea, dor de cabeça e dor abdominal. Não está aprovado no Brasil.
Esse é um dos tipos de terapia celular mais promissores e uma descoberta inovadora, e recente, da ciência, que objetiva a cura de alguns tipos de câncer do sangue.
“CAR” aqui representa chimeric antigen receptor (traduzido para o português, receptor quimérico de antígeno). O “T” refere-se ao linfócito T, um tipo de glóbulo branco essencial na proteção do organismo, que consegue reconhecer antígenos presentes na superfície de agentes, como os tumores, e produz anticorpos para combatê-los.
Este novo tipo medicamento é produzido a partir da modificação genética do linfócito T do próprio paciente, transformando-o então em CAR-T Cell.
O Tisagenlecleucel (Kymriah®) está aprovado pela Agência Nacional de Vigilância Sanitária (ANVISA) e já está sendo comercializado no Brasil. Ele é administrado em uma única infusão intravenosa. Importante reforçar que este é um medicamento personalizado e que será feito com as próprias células de defesa do paciente. Sua indicação é para pessoas com leucemia linfoblástica aguda de células B, crianças e adultos com até 25 anos de idade com doença refratária, em recidiva pós-transplante, ou em uma segunda ou posterior recidiva.
O medicamento não está disponível no Sistema Único de Saúde (SUS). Já na saúde suplementar (planos de saúde), sim.
PESQUISA E ESTUDOS CLÍNICOS – NOVOS HORIZONTES PARA O TRATAMENTO DA LEUCEMIA LINFOIDE AGUDA
Novas abordagens estão sendo avaliadas em estudos clínicos para o tratamento da LLA, e prometem aumentar a taxa de remissão e encontrar uma cura.
Testes clínicos
Pacientes com LLA são encorajados a participar de estudos clínicos, que testam novos medicamentos e tratamentos antes de serem regulamentados como padrão. Cada novo medicamento ou protocolo de tratamento passa por uma série de fases em estudos clínicos antes de se tornarem parte da terapia. Os estudos clínicos são cuidadosamente projetados e revisados por médicos e pesquisadores para garantir a maior segurança e precisão científica possível. A participação do paciente é cuidadosamente conduzida para ser a melhor terapia disponível. Os estudos clínicos são projetados para serem assertivos e muito seguros. Existem ensaios clínicos para pacientes recém-diagnosticados, com doença avançada e para os que são resistentes aos medicamentos estudados ou incapazes de tolerá-los.
Abordagens de pesquisa
Pesquisas científicas estão sendo feitas para aprender mais sobre LLA, como melhor tratá-la e como prestar o melhor atendimento a pessoas diagnosticadas.
Agentes estudados
Aqui estão alguns exemplos (e algumas descrições) de agentes específicos que estão sendo estudados em ensaios clínicos para LLA.
Inibidor do Proteassoma
Bortezomibe (Velcade®) – Este medicamento, aprovado para o tratamento de mieloma múltiplo e linfoma de células do manto, está sendo estudado em combinação com outros medicamentos de quimioterapia padrão para o tratamento da LLA recidivada ou refratária. Ele também está sendo estudado para o tratamento de pacientes pediátricos recém-diagnosticados com LLA de células T.
Antimetabólito
Clofarabina (Clolar®) – Já aprovada para o tratamento da LLA pediátrica, a clofarabina apresenta resultados promissores em estudos em adultos. Também está sendo estudada em combinação com outras drogas, como a mitoxantrona, em ensaios clínicos para o tratamento de crianças com LLA recidivada ou refratária.
Inibidor da Janus Kinase (JAK) 1 e 2
Ruxolitinib (Jakafi®) – Já aprovado para tratar pacientes com mielofibrose e policitemia vera, esta droga está sendo estudada em ensaios clínicos no tratamento da LLA refratária e recidivada pediátrica. Ele também está sendo estudado em combinação com vários medicamentos quimioterápicos no tratamento de crianças com ALT semelhante à Philadelphia (Ph) e alterações de CRLF2 e JAK.
Combinação especial de quimioterapia
Hiper-CVAD aumentada
A combinação hiper-CVAD (ciclofosfamida, vincristina, doxorrubicina, Adriamycin® e dexametasona) é um regime de tratamento bem estabelecido para a LLA em adultos. A formulação aumentada de hiper-CVAD foi projetada em 2011 e inclui doses intensificadas de vincristina e dexametasona juntamente com asparaginase. Os pesquisadores estão estudando a eficácia dessa combinação para o tratamento da LLA com outras drogas, incluindo a decitabina (Dacogen®).
Cromossomo Philadelphia Positivo (Ph +) na LLA.
Cerca de 25% dos adultos e apenas cerca de 3% das crianças que sofrem de LLA têm um subtipo denominado “LLA Ph-positivo” (também conhecido como “L +” ou “TLA positivo para o cromossomo Philadelphia”). Pacientes com este subtipo de LLA têm uma alteração cromossômica que resulta em uma mutação específica do gene BCR-ABL. Esses pacientes são tratados com os inibidores de tirosina quinase (TKIs) combinados com quimioterapia.
Esta combinação tornou-se o padrão no atendimento de pacientes com LLA Ph+. Novas combinações de drogas estão sendo estudadas em estudos clínicos para o tratamento.
Philadelphia semelhante na LLA
É um subgrupo de LLA de células B que possui características genéticas semelhantes à LLA Ph+, mas não possui o gene de fusão BCR-ABL. Tem mais incidência em homens e pacientes com Síndrome de Down e ocorre de quatro a cinco vezes mais em crianças e adultos jovens do que na LLA Ph+. A incidência de LLA Ph-semelhante é de 10% em crianças com LLA de risco padrão e acima de 25% em adultos jovens com LLA de risco padrão.
Está associado a um prognóstico desfavorável. Estudos recentes que analisaram o perfil genético de pacientes com LLA Ph-semelhante sugeriram que o uso de TKIs e outras terapias direcionadas pode ajudar, e essa é uma área de pesquisa clínica ativa.
Infância x Formas adultas de LLA
A forma adulta da LLA é a mais resistente ao tratamento. No entanto, nos últimos anos, vários fatores contribuíram para remissões mais longas e sobrevida prolongada em pacientes adultos.
Esses fatores incluem:
- Resultados melhorados com o transplante alogênico
- Uso de TKIs para o tratamento de LLA Ph+
- Uso de terapia intensiva pediátrica para adolescentes e adultos jovens
Para os pacientes com LLA acima dos 60 anos, a probabilidade de problemas de saúde e todas as características de risco são levados em consideração quando um plano de tratamento está sendo desenvolvido. A idade não é um motivo para suspender o tratamento. No entanto, os pacientes mais idosos podem ter uma resposta pior à terapia porque:
- As células leucêmicas têm maior ocorrência de anormalidades citogenéticas e moleculares desfavoráveis
- Os pacientes mais velhos podem ter outros problemas médicos, incluindo doença cardíaca, pulmonar, renal ou diabetes mellitus. O médico pode ter que selecionar drogas menos tóxicas ou diminuir a dosagem e a frequência do tratamento
O principal objetivo das terapias direcionadas aos pacientes com mais de 60 anos é manter a eficácia e minimizar os efeitos colaterais tóxicos. É importante saber que, mesmo em pacientes saudáveis com 75 anos ou mais, a principal causa de falha do tratamento não é a toxicidade, mas a falha do tratamento em eliminar as células cancerígenas.
Para pacientes com LLA resistentes ao tratamento ou com recidiva da doença, o transplante alogênico pode ser a melhor opção. Da mesma forma, pacientes com doença de alto risco são indicados para o transplante se for improvável que alcancem a remissão somente com a quimioterapia.
Um novo tipo de imunoterapia chamado “terapia de célula T de receptor de antígeno quimérico (CAR)” usa as próprias células do sistema imunológico do paciente para atacar e eliminar as células cancerígenas. Este tipo de imunoterapia está sendo estudada no tratamento da LLA refratária e recidivante em crianças e adultos. Converse com seu médico sobre tratamento em um ensaio clínico.
Adolescentes e adultos jovens.
Geralmente engloba pacientes entre 15 e 39 anos. Historicamente, eles eram tratados com um protocolo pediátrico ou adulto, dependendo da instituição de tratamento. Eles são diferentes:
- Protocolos pediátricos são mais intensos e complexos do que aqueles utilizados em idosos
- Tendem a usar mais pegaspargase, vincristina e corticosteróides.
Em contraste, os protocolos adultos, que tendem a usar mais ciclofosfamida e antraciclinas, como doxorrubicina e daunorrubicina
- Tratamentos pediátricos são feitos por longos períodos de tempo
O tratamento do sistema nervoso central é iniciado mais cedo e é mais duradouro. Algumas crianças recebem terapia de manutenção por até três anos, enquanto os adultos tendem a receber dois anos.
Pesquisadores de estudos clínicos começaram a investigar o uso de uma variedade de opções de protocolos pediátricos para estes pacientes. Eles descobriram que os tratados com protocolos pediátricos têm taxas de sobrevivência melhoradas em comparação com os pacientes da mesma idade tratados em protocolos de adultos com LLA.
Leucemia refratária ou leucemia recidivante
Alguns pacientes apresentam células leucêmicas residuais em sua medula, mesmo após tratamento intensivo. A doença é então chamada de “leucemia refratária”. Outros pacientes alcançam a remissão, mas têm um número reduzido de células sanguíneas normais e um retorno de células de leucemia na medula. A doença é considerada recidivante.
LLA PH+
Para pacientes com LLA Ph+ recidivante ou refratária, existem várias opções de tratamento. Ele pode receber uma terapia TKI diferente, mas antes de iniciar o tratamento, o teste de mutação do gene BCR-ABL deve ser feito. O objetivo é procurar por mutações no gene de fusão BCR-ABL que afeta o quanto certos os TKIs funcionam. Cada TKI funciona de maneira um pouco diferente. Um TKI pode ser capaz de neutralizar uma mutação que outro TKI não pode. Muitos pacientes com LLA PH+ recebem imatinibe (Glivec®) durante a terapia de indução. Para aqueles pacientes cuja doença recidivou, os medicamentos dasatinibe (Sprycel®) ou ponatinibe (Iclusig®) podem ser opções de tratamento.
O TKI pode ser administrado isoladamente, e fazer parte de um protocolo de quimioterapia ou, em alguns casos, pode ser combinado com um corticoide. Se o TKI fizer parte de um protocolo de quimioterapia, normalmente, a posologia será diferente daquela usada durante a terapia inicial. Para alguns pacientes mais velhos que não toleram a quimioterapia, uma terapia TKI e um corticoide podem ser opção. Se a LLA não responder ao tratamento com TKIs, os médicos podem recomendar protocolos para LLA recidivada ou negativa refratária.
Esses protocolos incluem:
- Blinatumomab (Blincyto®). Esta pode ser uma opção de tratamento para pacientes cuja LLA não respondeu a dois ou mais TKIs.
- Inotuzumab ozogamicina (Besponsa®). Esta é uma opção de tratamento para adultos com LLA de células B refratária ou recidivante.
- Tisagenlecleucel (Kymriah®). Este tratamento é para pacientes com LLA de células B que têm menos de 26 anos e apresentam doença refratária ou tiveram duas recaídas.
Um transplante alogênico de células-tronco também é uma opção para pacientes saudáveis que possuem um doador disponível. Alguns pacientes mais velhos e com problemas de saúde podem não tolerar um tratamento tão intenso.
LLA Ph
Para pacientes com LLA recidivada, Ph negativa, ou refratária, existem várias opções de tratamento. Uma opção é usar medicamentos diferentes dos que foram usados durante o primeiro protocolo de indução do paciente.
Estes medicamentos podem incluir:
• Blinatumomab
• Inotuzumab ozogamicina
• Protocolos com coquetéis que incluem vários medicamentos quimioterápicos, alguns dos quais podem ter sido administrados no passado. Exemplos:
- Hiper-CVAD aumentado:
Este regime inclui ciclofosfamida, vincristina, doxorrubicina (Adriamycin®), dexametasona, pegaspargase, metotrexato e citarabina.
- Doença CD20-positiva:
MOpAD – (metotrexato, vincristina [Oncovin®], L-asparaginase peguilada e dexametasona) com rituximabe para
No entanto, existem diferentes protocolos de quimioterapia que podem usar diversas combinações de medicamentos.
Alguns deles:
- Nelarabina para pacientes com LLA de células T
- Clofarabina
- Vincristina lipossomal (Marqibo®), para o tratamento de pacientes adultos com
Ph- LLA em segunda ou em maior número de recaídas ou ainda cuja doença progrediu após duas ou mais terapias antileucemicas
- Tisagenlecleucel
Na leucemia refratária, medicamentos diferentes daqueles usados no primeiro ciclo de tratamento podem ser administrados em um esforço para induzir à remissão. Após a remissão, o transplante de células-tronco pode ser uma opção e resultar em uma remissão mais duradoura. Em pacientes cuja doença recidivou, a duração da remissão, a idade do paciente e os achados citogenéticos nas células de leucemia influenciam a abordagem da terapia.
Converse com seu médico sobre terapias que estão em estudos clínicos para LLA refratária ou recidivante.
Depois que um paciente completa o tratamento para leucemia linfóide aguda (LLA) e está em remissão, testes de acompanhamento são realizados para verificar o funcionamento do tratamento e procurar sinais de recidiva. Os testes também verificam como os órgãos do paciente estão funcionando. Isso é importante, pois a LLA e seu tratamento podem danificar os órgãos. Durante o primeiro ano, um paciente passará por testes frequentes, mas os exames de acompanhamento são realizados com menos frequência durante o segundo e o terceiro ano. Com o passar do tempo, exames e check-ups menos frequentes podem ser necessários, mas as avaliações programadas devem continuar indefinidamente.
A National Comprehensive Cancer Network (NCCN) recomenda os seguintes exames durante os primeiros três anos após o término do tratamento:
Durante o primeiro ano após a conclusão da terapia
- Um exame físico completo (incluindo exame testicular) a cada 1 ou 2 meses
- Exames de sangue (hemograma completo [HC] com diferencial) a cada 1 ou 2 meses
- Testes de função hepática até que os valores normais sejam alcançados
- Punção da medula óssea, punção lombar e ecocardiograma, conforme indicação clínica
Durante o segundo ano após a conclusão da terapia
- Um exame físico completo (incluindo exame testicular) a cada 3 e 6 meses
- Exames de sangue (um hemograma completo com diferencial) a cada 3 e 6 meses.
Durante o terceiro ano depois do término de terapia
- Um exame físico completo (incluindo exame testicular) a cada 6 e 12 meses
- Exames de sangue (hemograma completo com diferencial) a cada 6 e 12 meses ou conforme orientado por um especialista
É importante manter um registro do tratamento do câncer para que o médico possa acompanhar os efeitos tardios específicos que podem estar associados. Essas informações incluem o diagnóstico, os nomes e as datas das medicações quimioterápicas, informações sobre tratamento de radiação, cirurgias realizadas, histórico de transplantes, detalhes sobre quaisquer outros tratamentos, nomes e datas de quaisquer complicações significativas e o tratamento recebido para essas complicações. Esta informação pode ajudar o médico a desenvolver um cronograma para visitas de acompanhamento e testes.
Adultos e crianças podem ter dificuldades quando retornam às suas rotinas diárias após um longo período de tratamento. É importante obter suporte durante todo esse tempo e pelo tempo que for necessário.
Efeitos a longo prazo do tratamento
Crianças e adultos jovens que foram tratados para a LLA podem ter maior risco de danos ao coração, outros tipos de câncer e problemas neurológicos ou cognitivos. Os pacientes devem ser acompanhados por um médico de cuidados primários para exames de saúde geral pelo menos uma vez por ano. Eles também devem ser examinados regularmente por um oncologista.
O tratamento para LLA às vezes causa efeitos que persistem após o término do tratamento (efeitos a longo prazo) ou se desenvolvem muito mais tarde na vida (efeitos tardios).
Vários fatores podem influenciar o risco de desenvolver efeitos a longo prazo ou tardios, incluindo:
- O tipo e duração do tratamento
- Idade no momento do tratamento
- Gênero e saúde em geral
A maioria dos pacientes com LLA é tratada com antraciclina, como a daunorrubicina. As antraciclinas têm sido associadas ao aumento do risco de lesão do músculo cardíaco ou insuficiência cardíaca crônica. A doença cardíaca pode não se tornar aparente até muitos anos após o término da terapia.
OSTEONECROSE
O que é osteonecrose?
A osteonecrose, também chamada de “necrose vascular” é a redução do fluxo sanguíneo para os ossos. O surgimento da osteonecrose e dor óssea, são potenciais efeitos colaterais a longo prazo associados à terapia com corticosteroides.
A osteonecrose frequentemente afeta as articulações que suportam peso, como os ossos e/ou joelhos do quadril, e parece ter uma incidência maior entre os adolescentes (provavelmente devido ao crescimento do esqueleto) do que em crianças mais jovens ou adultos. Para monitorar os pacientes que estão em risco de desenvolver essa condição, medidas de rotina dos níveis de cálcio e vitamina D devem ser obtidas e deve ser considerada avaliação periódica por imagem.
Às vezes, a radiação craniana é usada para pacientes com óbvio comprometimento da doença no sistema nervoso central (SNC) ou naqueles cuja doença recidiva. Os médicos estão limitando o uso deste tratamento (e com alternativas de terapia medicamentosa tanto quanto possível) para evitar o risco de efeitos a longo prazo ou tardios, como o comprometimento neurocognitivo e o desenvolvimento de segundo câncer.
As crianças podem sofrer efeitos colaterais do tratamento, tanto a curto como a longo prazo. Esses efeitos colaterais podem afetar o aprendizado, o crescimento, o desenvolvimento cognitivo e o desenvolvimento psicossocial. Quando as crianças retornam à escola, enfrentam novos desafios com suas famílias, para continuarem o tratamento. Por estarem cientes dos possíveis efeitos colaterais, os pais podem contar com a colaboração da equipe da escola para ajudar seus filhos a lidarem como as tarefas escolares. Estes e outros possíveis efeitos a longo prazo e tardios podem ser gerenciados.
Converse com seu médico sobre possíveis efeitos tardios e cuidados de acompanhamento.
Resultados do tratamento
Há algumas décadas, as taxas de cura eram muito baixas em crianças e adultos diagnosticados com LLA. Hoje, quase 90% das crianças e 40% dos adultos podem esperar remissão a longo prazo com sobrevida livre de leucemia e provável cura. Enquanto as taxas de cura de adultos ficam aquém das taxas de cura das crianças, as remissões nos adultos aumentaram nos últimos 10 anos e as remissões prolongadas também são mais frequentes.
Veja abaixo uma lista de dicas para combater e como amenizar os efeitos colaterais da quimioterapia
O tratamento da LLA, pode trazer alguns efeitos adversos ao paciente, mas é importante entender que é possível amenizá-los, seja com medicamentos ou até mesmo com a alimentação.
Aqui vão algumas dicas para te ajudar neste momento:
Contra náuseas e vômitos:
- Prefira alimentos frios ou gelados e diminua ou evite o uso de temperos fortes na preparação dos alimentos
- Coma pequenas porções várias vezes ao dia
Contra a diarreia:
- Aumente a ingestão de líquidos, como água, chá, suco
- Evite alimentos laxativos, como doces concentrados, leite de vaca, creme de leite, manteiga, queijos, verduras, cereais e pães integrais, além de frutas como mamão, laranja, uva e ameixa preta
Contra a obstipação (prisão de ventre):
- Evite o consumo de cereais refinados (arroz branco, farinha de trigo refinada, fubá, semolina, amido de milho, polvilho)
- Substitua alimentos pobres em fibras por alimentos ricos nesse nutriente (ex.: feijão, ervilha, lentilha, grão de bico, soja, arroz integral, linhaça, aveia…)
- Beba muita água
Contra a mucosite
- Evite alimentos picantes e salgados com temperos fortes e alimentos ácidos (ex.: limão, laranja pera, morango, maracujá, abacaxi e kiwi)
- Consuma preferencialmente alimentos macios ou pastosos (ex.: creme de espinafre, milho, purês, pães macios, sorvetes, flans, pudins e gelatinas) e também alimentos frios/gelados
Contra a xerostomia (boca seca)
- Beba líquidos em abundância (ex.: água, chá, suco, sopa)
- Aumente a ingestão de alimentos ácidos e cítricos
- Evite alimentos ricos em sal
- Chupe cubos de gelo ao longo do dia
- Utilize pomadas industrializadas (“salivas artificiais”) antes das refeições
Imunidade baixa:
Pode facilitar o surgimento das infecções. A febre é o aviso de que um processo infeccioso está começando, então não deixe de procurar o médico.