Você está na sessão de Leucemia Mieloide Crônica, para ver sobre outras Leucemias CLIQUE AQUI
LEUCEMIA MIELOIDE CRÔNICA TEM CURA?
Os médicos especializados para diagnosticar e tratar pacientes com cânceres do sangue, como a LMC, são chamados de “onco-hematologistas”. Esses médicos definem as opções de tratamento mais apropriadas para cada paciente.
A LMC não é curável com as terapias atualmente disponíveis, mas com os medicamentos existentes atualmente, cada vez mais pacientes alcançam remissões extremamente profundas. Por isto usamos o termo cura funcional.
Com estes medicamentos, a maioria das pessoas diagnosticadas com LMC em fase crônica tem uma boa qualidade de vida por muitos anos. O tratamento da LMC melhorou significativamente desde a introdução dos inibidores de tirosina quinase, como o mesilato de imatinibe (Glivec®), dasatinibe (Sprycel®) e nilotinibe (Tasigna®).
A introdução dos inibidores da tirosina quinase mudou potencialmente a forma fatal da doença para algo que pode ser controlado. Nem todos os pacientes, entretanto, respondem aos inibidores da tirosina quinase e é possível que os pacientes desenvolvam resistência a esses medicamentos.
O caminho do tratamento de cada paciente é baseado na fase da LMC no momento do diagnóstico, pontuação dos riscos, idade e outros problemas de saúde que o paciente possa ter.
DIMINUINDO O ALTO NÚMERO DE GLÓBULOS BRANCOS DO SANGUE
Alguns pacientes podem ter o número de glóbulos brancos do sangue alto no momento do diagnóstico. Essa contagem elevada pode, algumas vezes, prejudicar a circulação do sangue para o cérebro, pulmões, olhos e outros órgãos e pode também danificar pequenas veias sanguíneas. A Hidroxiureia (Hydrea®) pode ser usada para abaixar rapidamente essa contagem até que o diagnóstico de LMC seja confirmado por meio de exames de sangue e medula óssea.
A hidroxiureia é um remédio em cápsula tomado via oral. Abaixar o número alto de glóbulos brancos pode ajudar a diminuir o tamanho do baço. Uma vez feito o diagnóstico de LMC, os médicos, provavelmente, irão dar início ao tratamento com um inibidor da tirosina quinase e interromper a hidroxiureia.
Leucoaférese é um procedimento que usa um equipamento parecido com o da hemodiálise para remover os glóbulos brancos do sangue. A leucoaférese é usada para diminuir a alta contagem de glóbulos brancos se a LMC crônica for diagnosticada durante os primeiros meses da gravidez porque outros tratamentos podem ser prejudiciais ao desenvolvimento do feto.
FATORES PROGNÓSTICOS DA LMC:
Juntamente com as fases da LMC, existem outros fatores que interferem na decisão do tratamento e preveem o prognóstico do paciente (chance de recuperação). Esses são conhecidos como “fatores prognósticos” e são definidos no momento do diagnóstico. Nos pacientes com LMC, consideram-se fatores prognósticos menos favoráveis:
– Fase da LMC: fase acelerada ou blástica
– Idade: 60 anos ou mais
– Tamanho do baço: baço aumentado
– Contagem de plaquetas: muito alta ou muito baixa
– Blastos no sangue: alto número de blastos
– Basófilos e eosinófilos no sangue: aumento destas células
Muitos desses fatores são usados no sistema de pontuação do prognóstico para prever o resultado do tratamento para os pacientes de LMC. Atualmente, existem três sistemas de pontuação usados para determinar a pontuação de risco de um paciente:
– Sokal: baseado na idade do paciente, tamanho do baço, contagem de plaquetas e porcentagem de blastos circulando no sangue periférico (sangue circulando pelo corpo)
– Hasford: usa os mesmos fatores que o sistema Sokal, mas também inclui o número de eosinófilos e basófilos circulando no sangue periférico
– Estudo Europeu de Tratamento e Resultado (EUTOS): usa apenas a porcentagem de basófilos circulando no sangue periférico e o tamanho do baço.
Os médicos usam a pontuação de risco para determinar o tratamento. Os sistemas Sokal e Hasford categorizam os pacientes em três grupos: baixo risco,
risco intermediário e alto risco. Já o EUTOS categoriza os pacientes apenas como baixo ou alto risco. Geralmente, é mais provável que um paciente de LMC de baixo risco tenha melhores respostas ao tratamento.
Terapia com inibidores da tirosina quinase
O QUE É TIROSINA QUINASE?
É uma terapia alvo, ou seja, ela identifica e ataca tipos específicos de células de câncer, causando menos danos às células saudáveis. Os inibidores da tirosina quinase apresentam-se em comprimidos ou cápsulas, tomados por via oral. Na LMC, os inibidores da tirosina quinase têm como alvo a proteína anormal BCR-ABL, causadora do crescimento desordenado das células de LMC, fazendo, assim, com que as células malignas morram. Quatro terapias inibidoras da tirosina quinase são aprovadas para o tratamento de primeira linha:
– Mesilato de Imatinibe (Glivec®)
– Dasatinibe (Sprycel®)
– Nilotinibe (Tasigna®)
– Bosutinibe (Bosulif®)
Tratamento de primeira linha é a primeira terapia usada. Se o primeiro tratamento não funcionar por conta da intolerância (efeitos colaterais intoleráveis) a um remédio em particular ou a resistência ao medicamento (LMC não está respondendo ao tratamento), um tratamento de segunda linha é tentado. Se tanto o primeiro quanto o segundo tratamento falharem, uma terceira opção de tratamento pode ser oferecida. No caso de resistência e/ou intolerância ao tratamento de segunda linha, outras opções de tratamento com inibidores da tirosina quinase incluem Ponatinibe (Iclusig®) e Asciminibe (Scemblix®).
MESILATO DE IMATINIBE (GLIVEC®)
Foi aprovado em 2001 nos Estados Unidos para o tratamento de primeira linha para LMC. Como foi o primeiro inibidor da tirosina quinase desenvolvido, é conhecido como inibidor da tirosina quinase de primeira geração.
No Brasil também foi aprovado em 2001 e atualmente, na LMC, está indicado para: pacientes adultos e pediátricos (acima de 2 anos) com LMC Ph+ recémdiagnosticada e sem tratamento anterior; pacientes adultos com LMC Ph+ em crise blástica, fase acelerada ou fase crônica após falha ou intolerância à terapia com alfainterferona.
- É altamente eficaz e promove remissão estável na maioria das pessoas
- É usado como terapia inicial padrão para LMC crônica desde 2001
- Atualmente, o Imatinibe precisa ser tomado por tempo indeterminado ou até parar de fazer efeito
- Deve ser tomado junto com a refeição e com um copo grande de água
- É bem tolerado tanto em pacientes jovens quanto em pacientes mais velhos, embora a maioria das pessoas sintam efeitos colaterais. É importante que os pacientes digam para os seus médicos qualquer efeito colateral pois a maioria deles pode ser amenizado
MESILATO DE IMATINIBE EFEITOS COLATERAIS
– Náusea, vômito e diarreia
– Cãibras musculares e dores nos ossos
– Fadiga
– Erupções cutâneas
Embora raros, outros efeitos colaterais mais sérios do Imatinibe são:
– Baixa contagem de células do sangue, como glóbulos vermelhos (anemia), glóbulos brancos (infecções) e plaquetas (hemorragia)
– Edema (retenção de líquidos), com inchaço ao redor dos olhos, pés, pulmões ou coração
– Insuficiência cardíaca congestiva (capacidade do coração de bombear sangue prejudicada) e disfunção do ventrículo esquerdo (lado esquerdo do coração com as funções prejudicadas), principalmente em pacientes com outros problemas de saúde e fatores de risco. Pacientes que tenham propensão ou tenham doenças do coração devem ser monitorados e tratados para esse problema.
– Problemas graves no fígado
Alguns pacientes apresentam resistência ao Imatinibe, isto é, não conseguem tolerar os efeitos colaterais ou a medicação para de fazer efeito. Quando ocorre resistência, é preciso mudar o tratamento para outros inibidores da tirosina quinase.
DASATINIBE (SPRYCEL®)
Foi aprovado em 2006 nos Estados Unidos tanto para o tratamento de primeira linha para LMC, quanto de segunda linha. Como foi desenvolvido depois do Imatinibe, é conhecido como inibidor da tirosina quinase de segunda geração. No Brasil foi aprovado em 2007 e atualmente, na LMC, está indicado para: pacientes adultos com LMC Ph+ na fase crônica recém-diagnosticada; pacientes adultos com LMC Ph+ em crise blástica, fase acelerada ou fase crônica com resistência ou intolerância à terapia anterior incluindo Imatinibe.
EFEITOS COLATERAIS DO DASATINIBE
O Dasatinibe é tomado uma vez ao dia, de manhã ou de noite, podendo ou não ser acompanhado de comida. Os comprimidos não devem ser esmagados ou cortados. Eles devem ser ingeridos inteiros. Pacientes não devem tomar suco de toranja (grapefruit) 2 horas antes e depois de tomar o Dasatinibe, pois o suco de toranja (grapefruit) pode aumentar a concentração plasmática de Dasatinibe devendo, portanto, ser evitado. A Erva de São João pode diminuir as concentrações plasmáticas de Dasatinibe de maneira imprevisível e também deve ser evitada.
Estudos do Dasatinibe mostram que ele é mais potente e que induz a uma resposta molecular mais rápida que as respostas do Imatinibe. Até hoje, o Dasatinibe não mostrou aumento da taxa de sobrevida quando comparado com o Imatinibe.
Os possíveis efeitos colaterais comuns do Dasatinibe são:
- Náusea
- Diarreia
- Dores de cabeça
- Fadiga
- Fôlego encurtado
- Febre
- Erupção cutânea
O Dasatinibe pode causar efeitos colaterais mais sérios como:
- Baixa contagem de células do sangue, levando a anemia, infecções e sangramentos
- Retenção de líquidos ao redor dos pulmões, coração ou estômago
Pacientes devem ligar imediatamente para o médico em caso de qualquer um desses sintomas: suor por todo o corpo, ganho de peso, falta de fôlego e tosse especialmente com pouca atividade física ou no repouso, e dor no peito quando respirar profundamente.
Raramente pode desenvolver “hipertensão arterial pulmonar”, que é a pressão alta nas artérias dos pulmões. O médico deve checar os pulmões e o coração do paciente antes e depois do tratamento com Dasatinibe. Se um paciente é diagnosticado com hipertensão arterial pulmonar durante o tratamento, a medicação deve ser descontinuada permanentemente. A hipertensão arterial pulmonar pode ser revertida depois da descontinuação do medicamento.
NILOTINIBE (TASIGNA®)
Foi aprovado em 2007 nos Estados Unidos tanto para o tratamento de primeira linha para LMC, quanto de segunda linha. Como foi o desenvolvido depois do Imatinibe, é conhecido como inibidor da tirosina quinase de segunda geração.
No Brasil foi aprovado em 2009 e atualmente, na LMC, está indicado para: pacientes adultos com LMC Ph+ na fase crônica recém-diagnosticada; pacientes adultos com LMC Ph+ em fase crônica ou fase acelerada após falha ou intolerância a pelo menos uma terapia prévia, incluindo Imatinibe.9
O Nilotinibe normalmente é tomado duas vezes ao dia, com o estômago vazio. Não ingerir Nilotinibe com alimentos. Tomar as cápsulas pelo menos duas horas após a ingestão de qualquer alimento e, após tomá-las, esperar pelo menos uma hora para se alimentar novamente. Tomar o Nilotinibe com alimentos pode aumentar sua quantidade no sangue, o que pode ser prejudicial. Não comer ou beber produtos e sucos contendo grapefruit (toranja), carambola, romã, laranjas de Seville e outras frutas similares a qualquer momento durante o tratamento, pois podem aumentar a quantidade de Nilotinibe no sangue, aumentando o risco de efeitos colaterais sérios. Sempre que tiver dúvidas, consulte seu médico.
Estudos do Nilotinibe mostram que ele é mais potente e que induz a uma resposta molecular mais rápida que as respostas do Imatinibe. Até hoje, o Nilotinibe não mostrou aumento da taxa de sobrevida quando comparado com o Imatinibe.
NILOTINIBE EFEITOS COLATERAIS
Um efeito colateral grave é que ele pode causar problemas no ritmo cardíaco. Às vezes isso acontece quando o Nilotinibe interage com outros medicamentos ou suplementos, então é muito importante que o paciente fale para o médico sobre qualquer medicamento que esteja tomando, incluindo os que são vendidos sem receita médica.
Pacientes que precisam tomar antiácido (medicamentos que tratam azia) não devem tomá-lo junto com o Nilotinibe. Pacientes que tomam antiácido contendo hidróxido de alumínio, hidróxido de magnésio ou simeticona, devem tomá-lo duas horas antes ou depois de tomar o Nilotinibe.
Pacientes que tomam bloqueadores de H2 (bloqueadores do receptor de histamina tipo 2) devem tomar esse medicamento cerca de 10 horas antes de tomar o Nilotinibe ou duas horas depois de tomar.
Efeitos colaterais comuns incluem:
- Náusea, vômito, diarreia
- Erupção cutânea
- Dor de cabeça
- Fadiga
- Coceira
- Tosse
- Constipação
- Dores no músculo e juntas
- Nariz escorrendo ou entupido, espirros, dor de garganta
- Febre
- Suor noturno
Efeitos colaterais sérios do Nilotinibe incluem:
- Baixa contagem de células de sangue, levando a anemia, infecções e sangramentos
- Prolongamento do intervalo QT, um problema cardíaco sério que pode alterar o ritmo cardíaco. Essa condição pode ser fatal. Os pacientes devem contactar imediatamente o médico em caso de tontura, desmaio ou arritmia cardíaca enquanto estiverem tomando o Nilotinibe. Antes e durante o tratamento com esse medicamento, o médico deve avaliar a condição cardíaca do paciente através de um exame chamado eletrocardiograma (ECG)
- Diminuição do fluxo sanguíneo para as pernas, coração e cérebro
- Sintomas de mau funcionamento do fígado, incluindo pele e olhos amarelados Inflamação do pâncreas, os sintomas incluem dor no estômago com náusea e vômito
- Hiperglicemia (aumento do açúcar no sangue)
- Retenção de líquido. Sintomas incluem perda de fôlego, rápido aumento de peso e suor
PONATINIBE (ICLUSIG®)
Ponatinibe é um inibidor da tirosina quinase de terceira geração aprovada pelo FDA em 2012 para o tratamento de adultos com LMC na fase acelerada ou blástica caso nenhum outro inibidor de tirosina quinase seja indicado e para pacientes adultos com LMC com a mutação T315I na fase crônica, acelerada ou blástica. Foi aprovado no Brasil em junho de 2019.
Ponatinibe pode ser tomado com ou sem acompanhamento de comida. Ele tem como alvo todas as mutações na proteína BCR-ABL que são resistentes ao Imatinibe e outros inibidores da tirosina quinase. Esse medicamento, entretanto, pode causar graves efeitos colaterais e não é recomendado para qualquer paciente.
BOSUTINIBE (BOSULIF®)
É indicado para o tratamento de pacientes adultos com um tipo LMC positiva para o cromossomo Filadélfia (Ph+) em fase crônica (FC) e recém diagnosticada. Ele também é indicado para o tratamento de pacientes adultos com LMC Ph+ em fase crônica (FC), acelerada (FA) e blástica (FB), com resistência ou intolerância à terapia anterior. Já está aprovado no Brasil, pela Anvisa.
Efeitos colaterais do Busotinibe:
- Dor no estômago, diarreia, náusea e vômito
- Retenção de líquidos
- Erupções cutâneas
- Fadiga
Os efeitos colaterais mais graves incluem:
- Baixa contagem de células de sangue, levando a anemia, infecções e sangramentos
- Problemas no fígado
- Retenção de líquidos ao redor dos pulmões, coração e estômago
- Problemas nos rins
ASCIMINIB (SCEMBLIX®)
Este medicamento é indicado para o tratamento de pacientes adultos com leucemia mieloide crônica cromossomo Philadelphia positivo (LMC Ph+) em fase crônica (FC) que foram anteriormente tratados com medicamentos de um tipo semelhante chamados inibidores da tirosina quinase. Seu objetivo é bloquear a ação de uma proteína (BCR-ABL1) dos glóbulos brancos anormais, interrompendo sua divisão e crescimento.
Efeitos colaterais do Asciminib:
- Dentre os mais comuns estão sangramento espontâneo ou hematomas (sinais de nível baixo de plaquetas, trombocitopenia); febre, dor de garganta, infecções frequentes (sinais de nível baixo de glóbulos brancos do sangue, neutropenia); batimento cardíaco irregular e mudança na atividade elétrica do coração (prolongamento do intervalo QT).
RESISTÊNCIA AO INIBIDOR DA TIROSINA QUINASE, ADESÃO AO TRATAMENTO E INTERAÇÕES MEDICAMENTOSAS
A “resposta ao tratamento” é um termo usado para descrever a melhora alcançada pelo paciente devido ao tratamento que ele está fazendo. “Resistência ao medicamento” é o termo usado para descrever o motivo da doença não estar melhorando com o tratamento administrado.
A resistência ao medicamento acontece na LMC quando as células do câncer não respondem ao medicamento que está sendo usado para matá-las ou enfraquecê-las. Isto é, mesmo que o paciente esteja tomando o remédio, as células cancerígenas continuam crescendo.
“Resistência primária” é o termo que descreve a resistência a um medicamento que está sendo tomado pela primeira vez no tratamento. Esse tipo de resistência é mais rara em pacientes com LMC.
“Resistência secundária” é o tipo mais comum de resistência a um medicamento no paciente de LMC e acontece quando a célula cancerígena inicialmente responde ao tratamento mas depois para. Na LMC é comum por causa da mutação genética BCR-ABL. Essa mutação altera a forma da proteína BCR-ABL, o que pode afetar a ação bloqueadora dos inibidores da tirosina quinase, permitindo que as células cancerígenas cresçam novamente.
Às vezes, a resistência a um inibidor da tirosina quinase pode ser revertida ao aumentar a dose do medicamento ou ao trocar para outro inibidor. Um inibidor de tirosina quinase de segunda geração pode ser mais efetivo em tratar pacientes com mutações resistentes ao Imatinibe. A análise da mutação do gene BCR-ABL é um teste que identifica as mutações no gene BCR-ABL que são responsáveis pela resistência ao inibidor da tirosina quinase. Essa informação pode ajudar um médico a decidir qual medicamento prescrever.
Interações medicamentosas com Inibidores Tirosina Quinase
Alguns medicamentos, suplementos de ervas e até comidas podem afetar o modo como um inibidor da tirosina quinase trabalha no corpo. Corticoides, medicação anticonvulsiva, antiácidos e o suplemento erva de São João podem fazer alguns inibidores da tirosina quinase menos efetivos. Por outro lado, alguns antibióticos, medicamentos antifungos e produtos de toranja podem aumentar muito os níveis dos inibidores no sangue, tornando-o inseguro com efeitos colaterais sérios e até fatais. O paciente deve sempre dizer ao médico quais outros medicamentos, suplementos e vitaminas eles tomam para se ter certeza de que é seguro tomar produtos com os inibidores. E é importante perguntar ao médico sobre todas as comidas que devem ser evitadas.
ADESÃO AO INIBIDOR DE TIROSINA QUINASE
É importante que os pacientes tomem o seu inibidor da tirosina quinase como prescrito pelo médico.
Ter adesão ao inibidor de tirosina quinase ou a alguma uma terapia oral significa que o paciente:
– Toma corretamente a dose do medicamento
– Toma o medicamento no horário correto
– Nunca esquece uma dose
– Nunca toma uma dose extra
– Não toma o medicamento com líquidos, comidas e outros medicamentos não autorizados
Na maioria dos casos, os inibidores da tirosina quinase conseguem controlar a Leucemia Mieloide Crônica. Os pacientes não devem reduzir as doses para tentar diminuir os efeitos colaterais do medicamento. Deve-se falar ao médico qualquer efeito colateral sentido. Os médicos podem recomendar tratamento de suporte para ajudar os pacientes a lidarem com esses efeitos.
Os pacientes devem tomar a medicação como prescrita para conseguir a melhor resposta ao tratamento. A má adesão ao medicamento é o principal motivo por resposta inadequada ao tratamento. Assim, nunca pare de tomar o medicamento ou tome uma dose menor do que a indicada pelo médico.
Medicamentos usados para tratar a LMC aprovados no Brasil
Mesilato de imatinibe (Glivec®)
APROVADO PARA:
- Adultos e crianças recém-diagnosticados na fase crônica
- Adultos nas fases crônica, acelerada ou blástica após a terapia com interferon-alfa não ter funcionado
Dasatinibe (Sprycel®)
APROVADO PARA:
- Adultos recém-diagnosticados na fase crônica
- Adultos com resistência ou intolerância à terapia anterior nas três fases
Nilotinibe (Tasigna®)
APROVADO PARA:
- Adultos recém-diagnosticados na fase crônica
- Adultos com resistência ou intolerância à terapia anterior nas fases crônica ou acelerada
Ponatinibe (Iclusig®)
APROVADO PARA:
- Adultos que não podem ser indicados nenhum dos outros medicamentos
- Adultos com a mutação T315
Asciminib (Scemblix®)
APROVADO PARA:
- Tratamento de pacientes adultos com leucemia mieloide crônica cromossomo Philadelphia positivo (LMC Ph+) em fase crônica, que tenham utilizado previamente dois ou mais inibidores da tirosina quinase.
Bosutinibe (Bosulif®)
APROVADO PARA:
- Tratamento de pacientes adultos com um tipo de leucemia denominada leucemia mieloide crônica (LMC) positiva para o cromossomo Filadélfia (Ph+) em fase crônica (FC) e recém-diagnosticada.
- Também é indicado para o tratamento de pacientes adultos com leucemia mieloide crônica (LMC) positiva para o cromossomo Filadélfia (Ph+) em fase crônica (FC), acelerada (FA) e blástica (FB), com resistência ou intolerância à terapia anterior.
Medicamentos usados para tratar a LMC NÃO aprovados no Brasil
Omacetaxina mepesuccinato (Synribo®) – Inibidor de síntese proteica
APROVADO NO EXTERIOR PARA:
- Adultos recém-diagnosticados na fase crônica
- Adultos nas fases crônica ou acelerada que não estejam mais respondendo ou não conseguiram tolerar dois ou mais inibidores de tirosina quinase
Os seguintes medicamentos eram usados como terapia inicial antes dos inibidores da tirosina quinase serem introduzidos. Alguns pacientes podem ter indicação destas medicações:
- Interferon-alfa (Roferon-A®, Intron A®)
- Interferon-alfa peguilhada
- Hidroxiureia (Hydrea®)
- Ciperabina (Cytosar-U®)
- Bussulfano (Myleran®)
A quimioterapia normalmente é usada em pacientes de LMC que se encontram na fase blástica como uma forma de fazer a Leucemia Mielóide Crônica regredir à fase crônica. Às vezes, altas doses de quimioterapia são ministradas para preparar o paciente para um transplante alogênico de células-tronco.
O que é Imunoterapia?
A imunoterapia é um tipo de medicamento que estimula o sistema imunológico.
INTERFERON PARA QUE SERVE
O interferon é uma substância produzida naturalmente pelo sistema imunológico, mas também pode ser fabricada em laboratório. Ele reduz o crescimento e a divisão das células do câncer. Antes da introdução dos inibidores da tirosina quinase, o interferon era considerado tratamento de primeira linha para pacientes que não podiam receber o transplante alogênico de células-tronco.
Atualmente, essa terapia é menos usada para tratar LMC porque os inibidores da tirosina quinase são mais eficientes e causam menos efeitos colaterais. O interferon pode ser uma opção para alguns pacientes que não conseguem tolerar os efeitos colaterais dos inibidores ou mulheres grávidas.
EFEITOS COLATERAIS DO INTERFERON
O interferon pode causar efeitos colaterais significativos como:
– Problemas de concentração e memória
– Mudanças de humor
– Sintomas parecidos com gripe como dores no músculo, fadiga, febre, dor de cabeça, náusea, vômito e arrepios
– Baixa contagem de glóbulos brancos, vermelhos e plaquetas
Esses efeitos colaterais continuarão enquanto o paciente usar esse medicamento, mas com o tempo, podem ficar mais fáceis de serem tolerados.
Muitos pacientes, entretanto, não conseguem lidar com esses efeitos colaterais todo dia e precisam descontinuar o tratamento.
Transplante de células-tronco hematopoiéticas (TCTH)
O transplante alogênico de células tronco (infusão de células-tronco de um doador em um paciente) é uma opção para alguns pacientes de LMC. É o tratamento curativo para eles. Esse tipo de transplante, entretanto, pode causar sérios, ou até fatais, complicações e efeitos colaterais, e normalmente não é uma boa opção para pacientes mais velhos ou pacientes com outros problemas de saúde. Os resultados são muito semelhantes se o doador compatível for um parente ou uma
pessoa sem parentesco.
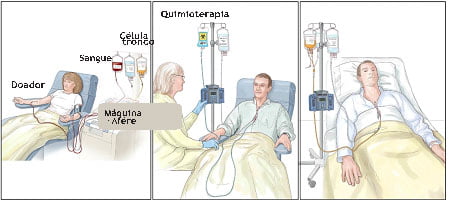
Foto 1: Células-tronco são coletadas do doador
Foto 2: Paciente recebe tratamento quimioterápico para destruir as células doentes
Foto 3: Paciente recebe as células-tronco do doador
A opção pelo transplante alogênico é cada vez mais rara porque muitos pacientes têm uma resposta muito boa aos inibidores de tirosina quinase, controlando a doença por um longo período e preservando a qualidade de vida sem os sérios riscos do transplante.
O médico irá considerar muitos fatores importantes ao decidir se o transplante alogênico é a melhor escolha de tratamento para um paciente. Esses fatores incluem a idade do paciente, saúde em geral, a fase da LMC, a resposta a outros tratamentos e a disponibilidade de um doador compatível. O transplante é considerado no caso de pacientes que tenham resistência a, pelo menos, dois tipos de inibidores de tirosina quinase; para pacientes que a LMC esteja na fase acelerada ou blástica e para pacientes que sejam intolerantes a todos os tipos de inibidores de tirosina quinase.
O fator prognóstico mais importante para a sobrevida após o transplante é a fase da LMC. Aproximadamente 90% dos pacientes com LMC crônica estarão livres da doença por 5 anos. Já os pacientes com LMC acelerada, de 40 a 50% deles estarão livres da doença após 5 anos e, apenas 10 a 20% dos pacientes com LMC blástica estarão livres da doença após 5 anos.
Cada fase da LMC requer um tipo diferente de tratamento.
A terapia com inibidores da tirosina quinase é padrão para a LMC na fase crônica pois a resposta ao tratamento é boa por longos períodos de tempo.
Hoje, são três tipos de inibidores da tirosina quinase estão aprovados no Brasil para o tratamento de primeira linha para LMC fase crônica. Eles são:
– Imatinibe 400 mg uma vez ao dia
– Dasatinibe 100 mg uma vez ao dia
– Nilotinibe 300 mg duas vezes ao dia
Ao escolher um inibidor de primeira linha, os médicos devem considerar fatores como condições de saúde pré-existentes, idade, pontuação de risco, cronograma de dose e custo. Depois de iniciada a terapia, o médico irá monitorar o paciente para determinar quão bem ele está respondendo ao tratamento. Um paciente que estiver respondendo bem, continuará com o seu tratamento atual. Se o paciente não estiver correspondendo às expectativas, o médico precisará descobrir o porquê.
Uma análise de mutação genética deve ser realizada para investigar as mutações no gene BCR-ABL. O médico também analisará se o paciente está ou não aderindo ao plano de tratamento. Se o tratamento atual não estiver funcionando, existem várias outras opções. Elas incluem:
– Alertar aos pacientes que não estão tomando a medicação como prescrita sobre a importância da adesão consciente ao tratamento
– Aumentar a dose do medicamento (se possível)
-Trocar por outro inibidor da tirosina quinase. Por exemplo, mudar o imatinibe pelo dasatinibe ou nilotinibe. Ou trocar por um dos novos medicamentos aprovados no país: asciminib, bosutimibe e ponatinibe, caso os medicamentos de primeira linha não estejam respondendo.
– Tentar quimioterapia
– Avaliar se o transplante alogênico de células-tronco é uma opção
Se a LMC passar da fase crônica para a fase acelerada durante o tratamento com a terapia de inibidor da tirosina quinase, o paciente pode tentar aumentar a dose inicial (se possível) ou trocar por outro inibidor que ainda não tenha sido tentado. Outras opções incluem:
– O inibidor ponatinibe para pacientes que não tenham respondido a dois ou mais inibidores e que tenham a mutação T315I
– O bosatinibe também é indicado para o tratamento de pacientes adultos com leucemia mieloide crônica
(LMC) positiva para o cromossomo Filadélfia (Ph+) em fase acelerada, com resistência ou intolerância à terapia anterior
– Transplante alogênico de células-tronco
Outra opção para pacientes com LMC acelerada é se submeter a um tratamento experimental, em estudo clínico – uma pesquisa feita por médicos para avaliar novos medicamentos ou novos usos para medicamentos já aprovados para outros casos. Estudos clínicos são um meio do paciente conseguir o mais novo tratamento para câncer. O objetivo da pesquisa clínica para LMC é melhorar o tratamento, melhorar a qualidade de vida e achar a cura.
Os pacientes devem discutir com o médico os possíveis benefícios e riscos de participar em um ensaio clínico.
Sobre o tratamento da fase blástica da LMC
Pacientes com LMC blástica têm um número maior de blastos. A doença na fase blástica age como uma leucemia aguda, com uma contagem de células do sangue mais alta e sintomas mais graves. É recomendado que o paciente se trate em um local especializado, com médicos que tenham expertise com pacientes de LMC em fase blástica.
É preciso fazer dois importantes testes antes de iniciar o tratamento para a LMC blástica. O primeiro teste determina se a fase blástica envolve blastos mieloides ou linfoides. Esse exame é necessário porque o tipo de célula define o tratamento. O segundo teste, uma análise da mutação do gene BCR-ABL, procura por mutações na parte BCR-ABL do gene que produz a proteína BCR-ABL.
Diferentes mutações podem fazer a proteína BCR-ABL mais ou menos resistente aos inibidores de tirosina quinase. Uma opção para os pacientes com LMC blástica é receber o tratamento com o bosutinibe. Este inibidor da tirosina quinas é indicado para pacientes que com resistência ou intolerância à terapia anterior.
Outra opção de tratamento é receber os inibidores de tirosina quinase, com ou sem quimioterapia, e depois fazer o transplante alogênico de células-tronco. No geral, na fase blástica da LMC é preferível usar inibidores de segunda geração porque são mais potentes.
Mesmo respondendo à essa terapia, os pacientes podem precisar do transplante alogênico de células-tronco. O resultado do transplante alogênico de células-tronco tem mais chance de ser bem-sucedido quando se consegue regredir da fase blástica para a fase crônica antes do transplante.
INDICE DE RESPOSTA
MEDINDO A RESPOSTA AO TRATAMENTO DA LMC
Após o início do tratamento o seu médico irá pedir, periodicamente, exames de sangue e medula óssea para determinar a sua resposta ao tratamento. Monitorar essa resposta é uma das estratégias chaves para administrar a LMC. Em geral, quanto melhor a resposta ao medicamento, mais tempo a doença ficará controlada.
A tabela 2 mostra os diferentes tipos de respostas ao tratamento.
Existem três tipos de respostas: hematológica, citogenética e molecular.
RESPOSTA HEMATOLÓGICA
Essa resposta é classificada como “parcial” ou “completa” dependendo dos resultados dos hemogramas. Esse exame mede a quantidade de glóbulos brancos, glóbulos vermelhos e plaquetas no sangue.
Resposta hematológica parcial
Os valores de cada tipo de células do sangue começam a voltar ao normal.
Resposta hematológica completa
Os valores das células do sangue voltam ao normal.
A maioria dos pacientes sob tratamento com os inibidores de tirosina quinase tem uma resposta hematológica completa dentro de três meses desde o começo do tratamento.
RESPOSTA CITOGENÉTICA
Avalia o número de células na medula óssea que contém o cromossomo Ph. Tanto o teste citogenético quanto o FISH podem ser usados para fazer essa medição.
Resposta citogenética completa
Nenhuma célula com o cromossomo Ph é detectada na medula óssea
Resposta citogenética parcial
O cromossomo Ph é achado em 1 a 35% das células
Resposta citogenética maior
O cromossomo Ph é achado em mais de 35% das células da medula óssea.
A citogenética da medula óssea é avaliada na consulta de acompanhamento de 3 e de 6 meses para verificar a resposta do paciente ao tratamento se o PCR não estiver disponível.
RESPOSTA MOLECULAR
A resposta molecular avalia a diminuição na quantidade de células com o gene BCR-ABL. O teste PCR conta o número de células no sangue periférico que contém o gene BCR-ABL. A resposta molecular inicial do paciente ao tratamento é importante para prever o resultado e para determinar as futuras opções de tratamento.
Resposta molecular precoce
Quando o nível do gene BCR-ABL é menor do que 10% no 3º e no 6º mês após o início do tratamento; significa que menos de 10% das células (10 a cada 100 células) têm o gene BCR-ABL.
Resposta molecular maior
Quando o nível do gene BCR-ABL é menor do que 0,1%; significa que 1 a cada 1.000 células têm o gene BCR-ABL, conhecido como “redução de 3 logs”.
Resposta molecular completa
Quando nenhuma célula tem o gene BCRABL, também conhecido como “resposta molecular profunda”.
ESCALA INTERNACIONAL, MEDIÇÃO DE TESTE DE PCR
É uma escala padrão para medir os resultados do teste PCR, isto é, medir o número de células que têm o gene BCR-ABL e determinar quão bem o tratamento está funcionando. A Escala Internacional define a linha de base padrão como BCR-ABL 100%. Uma redução de log indica que o nível de BCR-ABL diminuiu uma certa quantidade a partir da linha de base padrão.
– Redução de 1 log indica que o nível do BCR-ABL diminuiu 10 vezes abaixo da linha de base padrão. Isso significa que 10% das células (10 a cada 100 células) têm o gene BCR-ABL, também conhecido como “BCR-ABL 10%”. Essa redução é equivalente a resposta molecular precoce.
– Redução de 2 log significa que o nível de BCR-ABL diminui 100 vezes abaixo da linha padrão. Isso significa que 1% das células (1 a cada 100 células) têm o gene BCR-ABL, também conhecido como “BCR-ABL 1%”.
– Redução de 3 log significa que BCR-ABL diminuiu 1.000 vezes abaixo da linha padrão. Isso significa que 0,1% das células (1 a cada 1.000 células) têm o gene BCR-ABL, também conhecido como “resposta molecular maior”.
– Redução de 4,5 log significa que 0,0032% das células tem o gene BCR-ABL. Redução de 4,5 log é chamado de “resposta molecular completa” ou “resposta molecular profunda”. Alcançar a resposta molecular profunda é um sinal de que a doença está em remissão. Pacientes que alcançam e mantêm a resposta molecular profunda por um período significativo de tempo podem ser considerados como candidatos para descontinuar o medicamento em um estudo clínico.
O teste de PCR pode não estar padronizado entre os laboratórios, uma vez que estes estabelecem seus próprios padrões. Consequentemente, uma mesma amostra pode apresentar resultados diferentes se analisada em laboratórios distintos. Assim, para obter resultados mais consistentes, é melhor fazer os testes sempre no mesmo lugar. Isso ajudará os pacientes e a sua equipe de saúde a monitorarem com mais eficácia as respostas ao tratamento. É recomendado realizar o teste de PCR a cada três meses nos dois primeiros anos. Após dois anos, se o paciente estiver apresentando uma resposta ao tratamento satisfatória, o teste poderá ser feito a cada três ou seis meses.
| Tipo de resposta | Fatores | Testes usados para medir a resposta |
|---|---|---|
| Hematológica (resposta hematológica completa) | Contagem de glóbulos sanguíneos voltam ao normal. Nenhum blasto no sangue periférico. Nenhum sinal ou sintonia da doença. Baço volta ao tamanho normal. |
Hemograma completo com diferencial |
| Citogenética Resposta citogenética completa Resposta citogenética parcial Resposta citogenética maior Resposta citogenética menor |
Cromossomo Ph não detectado 1% a 35% das células tem cromossomo Ph 0% a 35% das células tem cromossomo Ph Mais de 35% das células tem cromossomo Ph |
Citogenética da medula óssea ou FISH |
PESQUISA E ESTUDO CLÍNICO
O que é Estudo Clínico?
São estudos que testam novos medicamentos e tratamentos antes de eles serem aprovados pelas agências regulatórias como tratamento padrão. Os pacientes com LMC podem participar de estudos clínicos.
Todo novo medicamento ou regime de tratamento passa por uma série de testes chamados “estudos clínicos” antes de começarem a fazer parte da terapia padrão. Os estudos clínicos são cuidadosamente montados e revisados por clínicos especialistas e pesquisadores para garantir tanta segurança e precisão científica quanto possível. Participação em um estudo clínico cuidadosamente conduzido pode ser a melhor opção de tratamento disponível. A participação de pacientes em estudos clínicos feitos no passado resultou em terapias usadas hoje em dia.
Estudos clínicos são desenhados para serem precisos e muito seguros. Existem estudos clínicos para pacientes recém-diagnosticados, para pacientes com LMC em fase avançada, e para pacientes que são intolerantes ou que tenham resistência ao seu medicamento atual. Às vezes, o estudo clínico é uma grande promessa para aumentar as taxas de remissão da LMC e para achar a cura.
ABORDAGENS DE PESQUISA
Os objetivos atuais das pesquisas com LMC são para:
- Desenvolver terapias verdadeiramente curativas
- Terapias que funcionem quando outras não tiverem dado certo
- Diminuir os efeitos colaterais do tratamento
As seguintes abordagens estão sob estudo clínico para o tratamento de pacientes de LMC.
MELHORAR OS TRATAMENTOS ATUAIS
Apesar dos ótimos resultados da terapia com os inibidores na LMC crônica, muitos estudos estão buscando um resultado ainda melhor. A pesquisa inclui:
- Determinar quais pacientes devem receber quais tipos de inibidores de tirosina quinase como terapia inicial
- Estabelecer qual é o melhor momento para trocar o tratamento inicial para o de segunda linha
- Descobrir se as respostas profundas são alcançadas quando outros agentes são adicionados aos inibidores
- Prevenir e/ou prever efeitos colaterais a longo prazo dos inibidores
Determinar quais pacientes podem, com sucesso, descontinuar os inibidores
TERAPIAS COM NOVAS DROGAS
Os inibidores de tirosina quinase tratam a LMC ao atacar a proteína BCR-ABL que coordena o crescimento das células de leucemia. É comum, entretanto, os pacientes de LMC não responderem total ou parcialmente ou tornarem-se resistentes a esses medicamentos. ABL001 é um medicamento experimental projetado para desativar a proteína BCR-ABL. Atualmente, os tratamentos com inibidores atacam a proteína BCR-ABL, mas o ABL001 tem como alvo um lugar diferente da proteína. Pesquisadores também estão estudando o medicamento rebastinibe.
Rebastinibe é um novo inibidor que também é desenvolvido para superar a resistência ao imatinibe, ligando-se a um local diferente da proteína BCR-ABL. Rebastinibe pode funcionar contra mutações, incluindo a T315I.
ESTRATÉGIAS DE ERRADICAÇÃO DA DOENÇA
Mesmo depois de parecer que a LMC foi tratada com sucesso, um número muito pequeno de células-tronco da leucemia pode continuar no sangue e na medula óssea do paciente. Essa condição é chamada de “doença residual mínima”. Essas células-tronco parecem ser resistentes à terapia com os inibidores. Isto levou a criação de estratégias destinadas a direcionar as vias de sinalização de células-tronco que estão envolvidas na sobrevida das células. Pesquisadores estão tentando obter uma melhor compreensão dos mecanismos que levam à sobrevida das células tronco leucêmicas de LMC.
Uma das áreas de pesquisa envolve inibidores de uma proteína chamada “smoothened” (SMO). É esperado que os inibidores tenham como alvo a proteína SMO achada nas células-tronco da LMC enquanto poupam as células saudáveis do sangue. Alguns outros caminhos são estudados e existem esforços contínuos para avaliar a sua importância para pacientes com LMC.
ESTUDOS DE DESCONTINUAÇÃO DOS INIBIDORES DE TIROSINA QUINASE
O tratamento da LMC com os inibidores tem avançado a um ponto onde muito pacientes alcançam níveis muito baixos ou indetectáveis do gene BCR-ABL no sangue. Pesquisadores estão estudando se alguns pacientes com resposta molecular profunda podem, com segurança, descontinuar o tratamento e ter uma remissão. Em um estudo clínico, aproximadamente 40% dos pacientes que alcançaram uma resposta molecular completa por pelo menos 2 anos estavam aptos a parar o tratamento com os inibidores sem uma recaída. Além disso, aqueles que tiveram uma recaída conseguiram restaurar a remissão ao retomar a sua terapia com os inibidores. Atualmente, descontinuar a terapia dos inibidores deve ser feita apenas dentro de estudos clínicos.
TERAPIA DE VACINA
Várias formas de terapia com vacinas são estudadas para verificar se elas podem reduzir ou eliminar as células de leucemia remanescentes no paciente com LMC. Os inibidores de tirosina quinase destroem a maioria das células leucêmicas no corpo, mas, na maioria dos pacientes, algumas células cancerosas ainda permanecem. Essas células podem causar uma recaída, especialmente se a terapia dos inibidores for parada. Pesquisadores tentam achar maneiras de ajudar o sistema imunológico a reconhecer a diferença entre as células normais e as de LMC para que o organismo possa atacar as células que restaram após os inibidores de tirosina quinase.
TRANSPLANTE DE CÉLULAS-TRONCO COM INTENSIDADE REDUZIDA
Uma forma modificada do transplante alogênico é conhecido como transplante alogênico de células-tronco com “intensidade reduzida” ou “não mieloablativo”. Ele pode ser uma opção para pacientes que não responderam aos outros tratamentos. Um paciente que está sendo preparado para um transplante de intensidade reduzida recebe doses menores de quimioterapia e/ou radioterapia na preparação para o transplante, comparado com as doses dadas aos pacientes que fazem o transplante alogênico comum. Os medicamentos imunossupressores são usados para prevenir que o corpo do paciente rejeite a doação das células-tronco do doador. As células do sistema imunológico do doador podem atacar as células da LMC do paciente (chamado “efeito transplante versus tumor”).
A teoria que é testada com o transplante de intensidade reduzida é que ao realizar procedimentos menos tóxicos antes do transplante, o corpo fica mais apto a resistir ao transplante, porém ainda com o efeito desejado “transplante versus tumor”.
Outros medicamentos estão sendo testados em estudos clínicos para aumentar o efeito enxerto versus leucemia do transplante de células-tronco e reduzir os riscos de doença do enxerto contra o hospedeiro.
| Tipo de resposta | Fatores | Testes usados para medir a resposta |
|---|---|---|
| Hematológica (resposta hematológica completa) | Contagem de glóbulos sanguíneos voltam ao normal. Nenhum blasto no sangue periférico. Nenhum sinal ou sintonia da doença. Baço volta ao tamanho normal. |
Hemograma completo com diferencial |
| Citogenética Resposta citogenética completa Resposta citogenética parcial Resposta citogenética maior Resposta citogenética menor |
Cromossomo Ph não detectado 1% a 35% das células tem cromossomo Ph 0% a 35% das células tem cromossomo Ph Mais de 35% das células tem cromossomo Ph |
Citogenética da medula óssea ou FISH |